近日,我校食品与生物工程学院王峰教授课题组在药物制剂研发领域取得系列进展。相关研究工作分别发表在《ACS Nano》和《ACS Applied Materials & Interfaces》上。

工程化的药物递送系统旨在增强药物的溶解性、延长药物在体内的循环时间、提升药物的组织靶向能力。尽管纳米材料已广泛用于药物递送系统研究中,开发高效穿透细胞和组织屏障的药物递送系统仍面临着巨大的挑战。在过去十多年的时间里,科研工作者开发了一系列具有运动性质的纳米颗粒,即纳米马达用于药物的有效递送。其中,基于化学能转化的纳米马达系统,在构建不对称的纳米结构的基础上,可实现纳米马达的运动特性。值得指出的是,之前大多数纳米马达的不对性来自于单个纳米颗粒本身,例如Janus SiO2,和Janus Mg/Pt颗粒等。考虑到脂质膜本身的流动性,课题组通过调节磷脂的组成、相态、胆固醇等,实现了金-铂纳米颗粒(Au@Pt)在脂质体上的可控不对称组装行为,建立了一类脂质体纳米马达系统。该类纳米马达膜上不对称的Au@Pt使其具有优异的过氧化氢酶活,可促进H2O2分解,产生O2推动纳米马达的定向运动。在此基础上,该研究还发现负载化疗药物的脂质体纳米马达可被肿瘤细胞高效摄取;而对含有细胞壁的植物叶片,也具有很好的细胞透过能力。上述脂质体纳米马达系统在生物医学和植物纳米技术中具有广阔的应用价值。相关论文发表在ACS Nano上,合肥工业大学硕士研究生王镇峰、博士研究生闫勇、课题组李超副教授为该文的共同第一作者,合肥工业大学为唯一通讯单位,王峰教授为独立通讯作者。
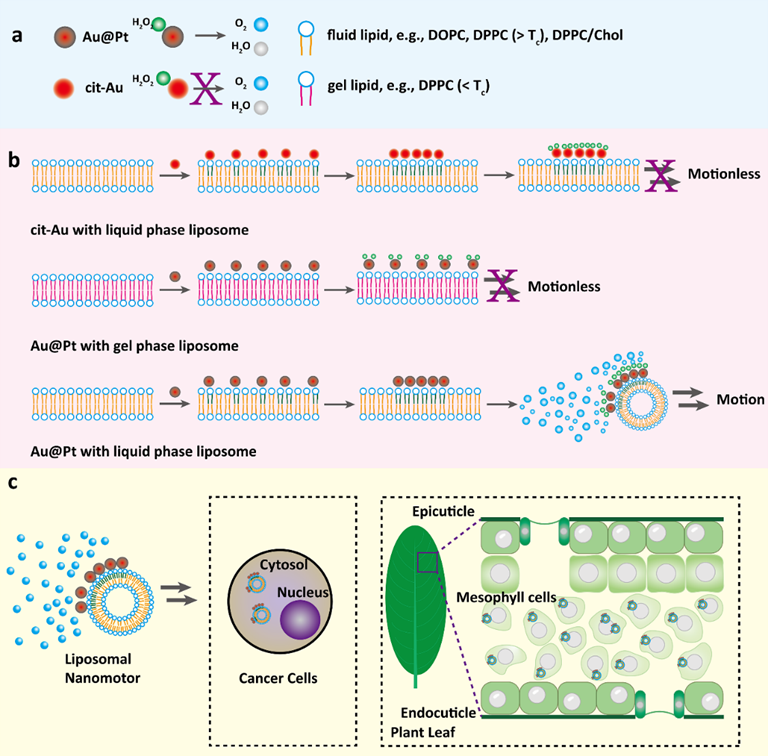


脂质体纳米马达的合成思路及其高效肿瘤细胞、植物叶片摄取示意图
纳米胶水是由聚合物或纳米颗粒制成的生物粘合剂,可将两个非粘合表面粘合在一起(Nature2014,505, 382-385;Angew. Chem.2014, 58, 6369-6373),目前已广泛用于水凝胶粘附、美容、止血、伤口闭合与修复等领域。受纳米颗粒溶液作为凝胶和生物组织粘合剂的启发,课题组以片状二氧化锰作为粘合剂,将核酸分子“粘合”在脂质体的表面,并用于肿瘤光-基因治疗,这拓展了纳米胶水的内涵。课题组以核酶(DNAzyme,即一种可以在辅助金属离子存在下,切割细胞内的mRNA)的分子作为模型核酸,两性脂质体作为模型脂质体,构建基于片状二氧化锰的脂质体纳米胶水。在细胞内氧化还原条件下,二氧化锰被还原成锰离子并联合DNAzyme切割细胞内相应的mRNA分子,实现对肿瘤细胞的杀伤。为了实现脂质体纳米胶水的光-基因治疗功能,借助核磁共振成像,对负载光敏剂脂质体纳米胶水进行了充分的生物医学评价。该脂质体纳米胶水系统不仅为递送核酸药物提供了高效、经济的平台,也为其他生物大分子在脂质体上的修饰提供了新的思路。相关论文发表在ACS Applied Materials & Interfaces上,合肥工业大学硕士研究生余月、王镇峰为该文的共同第一作者,合肥工业大学为唯一通讯单位,王峰教授为独立通讯作者。
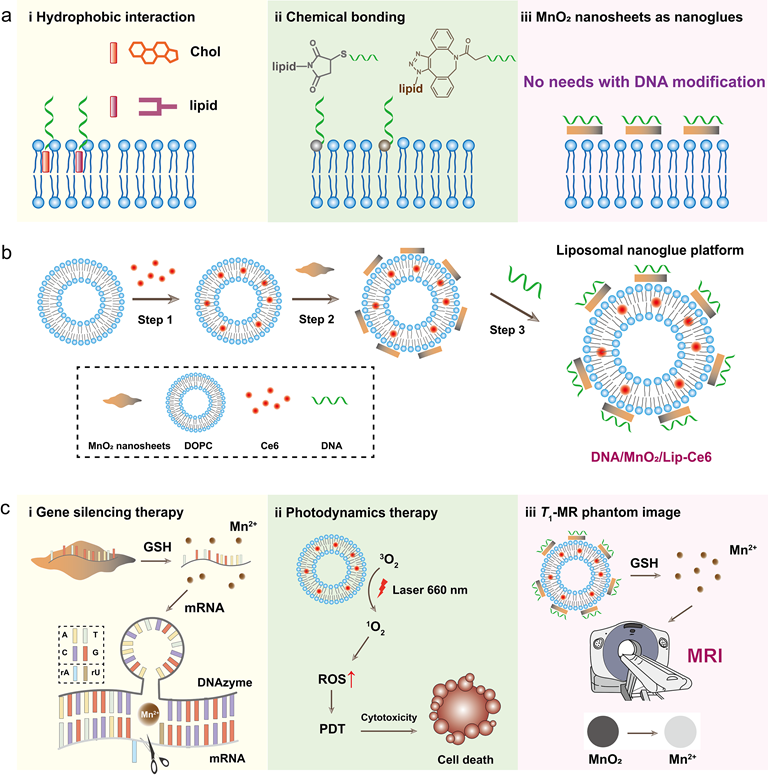
脂质体纳米胶水的合成思路及在光-基因治疗应用示意图
上述研究工作得到了国家自然科学基金、安徽省重点研发计划项目、安徽省杰出青年基金、中央高校基本科研业务费专项等支持。王峰教授致力于研究纳米-生物界面,在纳米材料与脂质膜、细胞膜、含细胞壁的细胞膜互作上取得多项高水平研究成果。迄今,在国内外期刊发文56篇,第一/通讯作者在JACS(1篇),Angew. Chem.(1篇),Adv. Mater.(2篇),ACS Nano(3篇)等发文31篇。所有论文被引3380次(Google学术数据),6篇论文被引超过100次(单篇最高被引753次)。获批国自然3项(面上2项,青年1项)。
原文链接:
1. ACS Nano:https://pubs.acs.org/doi/10.1021/acsnano.2c00327
2. ACS Applied Materials & Interfaces:https://pubs.acs.org/doi/10.1021/acsami.2c04022
(陶伟/文 王峰/图 李艳/审核)
责任编辑:程婷婷
